最新动态
美国FDA批准罕见病新药能使疾病发作减少95%
近几天,美国FDA好消息不断。继周一批准了一款历时17年才得以最终上市的新型抗生素后,今日,美国FDA又批准了本周第二款新药Haegarda。这款由CSL Behring带来的新药能预防青年与成人患者遗传性血管性水肿(HAE)的发作。值得一提的是,这也是首款获批的皮下注射型C1酯酶抑制剂(C1 esterase inhibitor,C1-INH)。
HAE是一种遗传性疾病,患者的血液内缺乏一种叫做C1酯酶抑制剂的蛋白,从而引起补体系统的紊乱,导致异常症状。具体说来,HAE患者会在面部、四肢、胃肠道等出现突然水肿,不但让患者处于虚弱与痛苦之中,更有可能因为喉咙部位肿胀而影响呼吸,危及患者的生命。据估计,全世界范围内每1万人至5万人里就有1人患有这种罕见遗传病,他们需要一种能改善生活质量的有效疗法。
由CSL Behring带来的Haegarda是一款从人类的血浆中获取,并经过了纯化、巴氏法消毒、冻干制备的C1酯酶抑制剂。通过皮下注射,它有望能预防HAE的发作。先前,它也曾获得过美国FDA颁发的孤儿药资格。
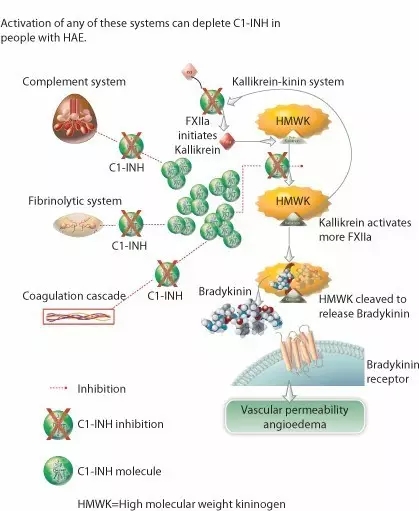
C1-INH类新药的工作原理(图片来源:CSL Behring官方网站)
在一项多中心的临床试验中,这款新药预防HAE发作的功效得到了确认。该研究招募了90名HAE患者,年龄跨度为12岁到72岁。这些患者被随机分为两组,一组每周两次接受每公斤40 IU的新药注射治疗,另一组则每周两次接受每公斤60 IU的新药注射治疗。在为期16周的治疗期之外,这两组患者还接受了为期16周的安慰剂治疗(部分在治疗期前接受安慰剂,部分在治疗期后接受安慰剂)。与安慰剂治疗阶段相比,这两组患者在使用新药治疗的阶段中,HAE发作率分别下降了89%与95%,预防效果堪称显著。此外,在第二组中,有40%的患者完全没有出现HAE的发作。它也没有出现明显的副作用。基于这些出色的临床数据,美国FDA批准了这款新药上市。
“Haegarda的获批上市给青年和成人HAE患者带来了全新的治疗方案,”美国FDA生物制品评估与研究中心主任Peter Marks博士说道:“皮下注射制剂也让患者能在自己家里使用这款产品,预防HAE发作。”
我们祝贺HAE患者迎来预防效果如此显著的新药,也祝愿更多预防和治疗罕见病的新药能够尽快问世,造福患者群体。(信息来自网络)




 微信公众号
微信公众号
 微信订阅号
微信订阅号
 抖音号
抖音号
 快手号
快手号

